ПОШТОВАНИ УЧЕНИЦИ,да не би губили час због моје повреде поставићу Вам лекцију на блог,препишите је.Видимо се у четвртак.

Хемијска супстанца или супстанција је облик постојања материје. То је чулима доступан облик материје.
Састоји се од веома ситних честица — атома. Данас је познато око 17 милиона различитих супстанци. Од толиког броја супстанци, око 100 хиљада има практичну примену. Неке супстанце налазе се у природи, док се друге производе вештачким путем.
Свака супстанца има карактеристична својства по којима се разликује од других супстанци, на пример: боју, мирис, густину, температуру топљења, температуру кључања. Наведена својства супстанци, која се одређују помоћу наших чула или инструмената, називају се физичка својства. Хемијска својства супстанци испољавају се при њиховим реакцијама са другим супстанцама. Основни задатак хемије је изучавање супстанци — њихове структуре, својстава, као и промена које доводе до претварања једних супстанци у друге.
ПРЕПИШИ ЛЕКЦИЈУ У ШКОЛСКУ СВЕСКУ!
3.9.2020.Сања Тошић
01.06.-05.06.2020.
Поштовани ученици, на почетку наредне школске године радићете иницијални тест који подразумева градиво које имате на овом линку :
https://hemija024.files.wordpress.com/2014/09/pregled-gradiva-iz-kemije-za-7.pdf
Скраћена верзија и најбитнији појмови које смо научили у седмом разреду налазе се на њему. Сачувајте линк, свакако нам знање треба и за осми разред и пријемни испит наредне године.
Сачувајте школске свеске из седмог разреда.
Срдачан поздрав!
25.052020.-29.05.2020.
СИСТЕМАТИЗАЦИЈА ГРАДИВА СЕДМОГ РАЗРЕДА
Поштовани седмаци, све што је важно а да смо научили у седмом разреду имате у овом линку.ОБАВЕЗНО ДОБРО ПОГЛЕДАЈТЕ и сачувајте линк, требаће нам и следеће школске године.
https://hemija024.files.wordpress.com/2014/09/pregled-gradiva-iz-kemije-za-7.pdf
Срдачан поздрав!
ДЕСЕТА РАДНА НЕДЕЉА 18.-23.05.2020.
Количина супстанце .Моларна маса-обрада

| ka | Značenje | Iznos i merna jedinica |
|---|---|---|
| n | količina supstance | ? mol |
| m | masa materije | ? g |
| M | molarna masa materije | (Ar ili Mr) gmol-1 |
| N | brojnost materije | ? (nema merne jedinice) |
| L | Avogadrova konstanta | 6,022•1023 mol-1 |
| V0 | zapremina supstance pri standardnim uslovima (0 °C, 101325 Pa) | ? dm3 |
| Vm | molarna zapremina supstance | 22,4 dm3 mol-1 |
ПОГЛЕДАЈ ЛИНК: https://www.youtube.com/watch?v=OAEo5dSqtSM
https://www.youtube.com/watch?v=-Qe2ebuc5s8
Задатак:
- Прочитај лекцију из уџбеника страна 154
- Препиши лекцију са блога, обавезно табелу!
- Препиши из уџбеника све што је црвеном бојом у лекцији
- За домаћи задатак одговори на следећа питања, сликај и пошаљи:
- Која је ознака за количину супстанце?
- Која је јединица?
- Шта је количина супстанце?
- Шта је Моларна маса?
- Која је ознака, а која јединица за Моларну масу?
ДЕВЕТА РАДНА НЕДЕЉА 11.5.2020.-16.5.2020.
ЗАКОН СТАЛНИХ ОДНОСА МАСА - ПРУСТОВ ЗАКОН

Погледај линк:
https://www.shtreber.com/zakon-stalnih-odnosa-masa
Погледај линк: https://www.youtube.com/watch?v=KnmtfQtvCl8
Пример 1:
Пример 2:
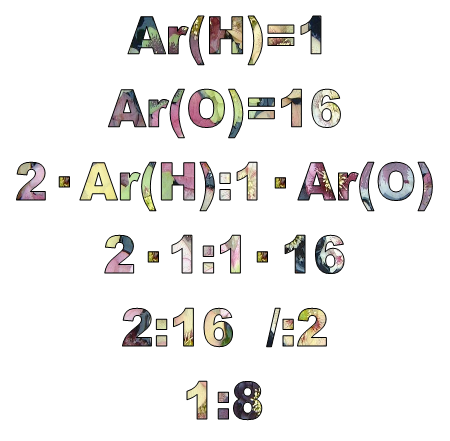
Пример 3:
Основни хемијски закони
Закон сталних масених односа (Прустов закон)
Закон вишеструких масених односа (Далтонов закон)
ЗАДАТАК:
- Препиши лекцију са блога
- Прочитај лекцију из књиге
- Погледај линкове
- До уторка пошаљи слику преписане лекције, до 15 сати
- У уторак ће бити постављени задаци
ОСМА РАДНА НЕДЕЉА 04.05.2020.-09.05.2020.
ХЕМИЈСКЕ РЕАКЦИЈЕ.ЗАКОН О ОДРЖАЊУ МАСЕ
прво погледај линк: https://www.youtube.com/watch?v=YeoXASloUzI
Укупна маса реактаната једнака је укупној маси реакционих проивода.
Пример: ако реагује 4 грама водоника са 32 грама кисеоника, маса настале воде биће 36 грама.

Хемијске реакције представљају се хемијским реакцијама.
При састављању хемијске реакције примењује се закон о одржању масе!
ПРАВИЛА:
- формуле тј.симболи реактаната пишу се са леве стане
- формуле реакционих производа пише се са десне стране
- лева и десна страна повезане су стрелицом која има смер од реактанта ка производу
- једначина мора бити изједначена!
https://www.youtube.com/watch?v=CdOIXU-Gcu8 погледај линк!!!!
.jpg?1484478710538)
Погледај линк: https://www.shtreber.com/zakon-o-masi
Задатак:
- Препиши лекцију са блога
- Прочитај лекцију из уџбеника
- страна 150 уради питања у школску свеску
СЕДМА РАДНА НЕДЕЉА
27.04.2020.-30.04.2020.
- Шта је оглед?
- Објасни разлику између анализе и синтезе
- Наведи пример реакције синтезе
- Да ли је сагоревање угља хемијска реакција? Објасни свој одговор
- Одреди производ реакције у следећој реакцији Ca + H2O-----Ca(OH)2 + H2
- Одреди производ реакције у следећој реакцији Mg +H2O-----Mg(OH)2 + H2
- Одреди реактанте у реакцији у следећој реакцији CO2 +H2O----H2CO3
Шеста радна недеља 21.4.-24.4.2020.
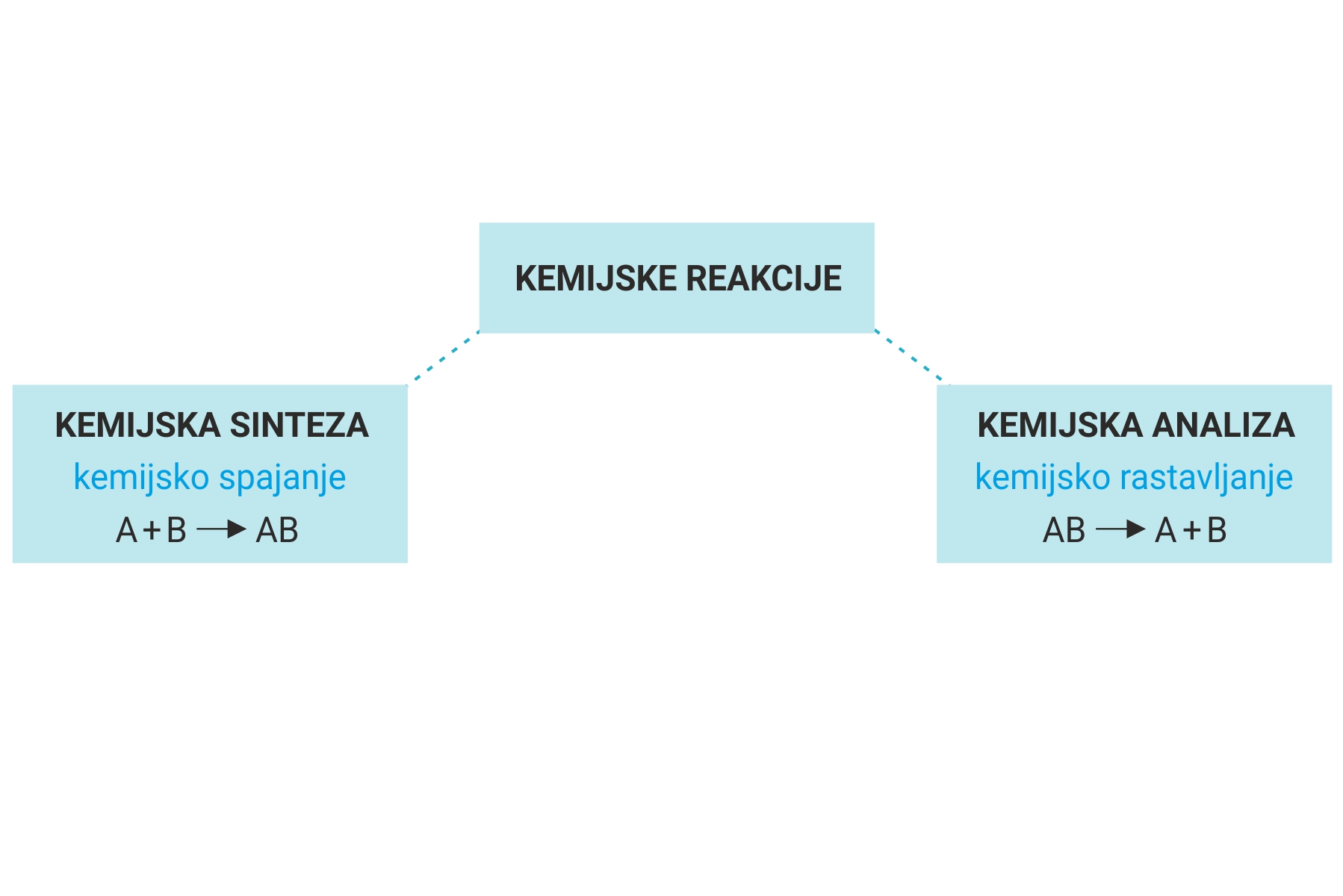

- Реакције синтезе су хемијске реакције при којима из атома и молекула различитих супстанци настају молекули нових супстанци, опште једначине:
- А+Б=АБ
- Реакције анализе су хемијске реакције при којима се молекули једне супстанце разлажу на атоме или молекуле других супстанци, опште једначине:
- АБ-А+Б
- Препиши лекцију са блога
- Погледај линкове на блогу, лакше ћеш схватити градиво.
- Прочитај лекцију из уџбеника страна 142.
- Одговори на питања из уџбеника страна 144 у школској свесци
- Сликај, пошаљи домаћи на мејл или вибер.
- У коментару на блогу потврди да си урадио домаћи
ПЕТА РАДНА НЕДЕЉА
14.04.2020.-16.04.2020.
Обнављање, утврђивање:
Задаци за вежбу ( припрема за контролни рад):
- Шта су водени раствори?
- Како се одређује која је супстанца растварач у неком раствору?
- Шта је процентна концентрација раствора?
- Израчунај процентну концентрацију воденог раствора насталог мешањем 180 грама воде и 20 грама шећера.
- Објасни циклус кружења воде у природи
- Која је разлика између кишнице и морске воде?
- Које су одлике воде за пиће?
- Шта је дестилована вода?
- Објасни структуру молекула воде
- У којим агрегатним стањима се налази вода
- Шта проучава хемија
- Шта је експеримент
- Шта су материја и супстанца
- Како је грађен Атом
- Како се одређује валенца ?
- Како се рачуна релативна атомска маса?
- Ковалентна веза
- Јонска веза
- ХЕМИЈСКИ СИМБОЛИ
- Врсте формула
Четврта радна недеља 06.04.-09.04.2020.
ЗНАЧАЈ ВОДЕ ЗА ЖИВИ СВЕТ/ОБРАДА
Прво погледај линк: https://www.shtreber.com/voda
- Атмосферска вода настаје од падавина као што су киша, снег и лед. Она садржи растворене гасове са којима долази у додир, попут кисеоника и угљен-диоксида. Од чврстих материја садржи нешто прашине и чађи, а у близини мора и нешто соли.
- Површинска вода је она која или лежи на површини тла. Ова вода настаје од атмосферске воде, која директно пада на Земљину површину или оне која се слива у њу са површине тла.
- Подземна вода се налази испод површинске земље. Настаје продирањем падавина од површинских водених токова ка тзв. водонепропусним слојевима (унутар Земљине површине) који се састоје од стена са малом ефективном порозношћу. Ова вода спада у ред чистијих, па се због таквих одлика веома често користи за пиће.[9]
Задатак:
- Најосновније одлике воде препиши у свеску
- прочитај лекцију из уџбеника страна 133.
- ДОМАЋИ: у школској свесци одговори на питања са стране 137 у уџбенику
Трећа радна недеља, 30.03.2020.-03.04.2020.
Релативна молекулска маса, Раствори ( утврђивање)
- Прочитај лекције из школске свеске, да обновиш градиво, пре него започнеш решавање задатака!
- Реши задатке уз помоћ свеске и уџбеника
- Пошаљи слику урађених задатака
- Пошаљи поруку уколико постоје нејасноће у изради задатака
- У коментару на блог напиши име и да ли си урадио домаћи
- У уторак и четвртак за време школског часа заједно ћемо дискутовати о решењима задатака.
- Израчунај релативну атомску масу HCL ( ХЛОРОВОДОНИЧНА КИСЕЛИНА)
- Израчунај релативну атомску масу H2SO4 (СУМПОРНА КИСЕЛИНА)
- Израчунај релативну атомску масу ВОДЕ
- Израчунај релативну атомску масу О2
- Одреди која је супстанца растварач у раствору који настаје мешањем 300 грама воде и 50 грама алкохола? објасни одговор
- Раствор чине 10 грама шећера и 30 грама воде, ко је растварач? зашто?
- Која је процентна концентрација раствора раствора који садржи 2 грама растворене супстанце у 50 грама раствора?
Друга радна недеља 23.03.2020.-27.03.2020.
ПРОЦЕНТНИ САСТАВ РАСТВОРА- обрада нове лекције
Процентна концентрација раствора представља број грама растворене супстанце у 100 грама раствора.
Изражава се у процентима. %
Раствор соли који је двадесетопроцентни ( 20% )садржи 20 гр соли у 100 грама воде.
Ознака је W и то је маса супстанце у 100 грама раствора.
Погледај линк: https://www.shtreber.com/maseni-procentni-sastav-rastvora
Израчунава се по формули : W = Masa rastvorene supsance : masa rastvarača x 100 ( : znači podeljeno, a x znači puta-mnozenje)
пример :
Zadaci - RASTVORI - maseni udio i procentna koncentracija
Procentna koncentracija se izražava u procentima i računa se prema obrascu:
Procentna koncentracija= (masa rastvorene supstance / masa rastvora) * 100%
W(%) = (mrs / mras) * 100%
W(%) = (mrs / mras) * 100% mrs je nepoznata pa ćemo je označiti sa X - računamo za glukozu5%=(Х/300g)*100%Х=(5*300g)/100Х=15g glukoze300-15=285 g vode
- Препиши лекцију са блога у школску свеску
- Прочитај лекцију из уџбеника страна 129
- Провежбај примере из уџбеника ( дат је и задатак и објашњење решења)страна 130.
- Домаћи: страна 132 уџбеник прва 3 задатка
- Када урадиш задатак сликај ( вибер) или пошаљи на мејл
- У коментару на блогу упиши датум, име и презиме и да ли си урадио
- Рок је до петка 27.03.2020.након чега ћу унети у дневник Вашу активност
У радној недељи 16.03.2020.-20.03.2020. предвиђена је планом обнова наставне јединице: Раствори и растворљивост
Погледај линк:
https://www.shtreber.com/rastvori
https://www.shtreber.com/sl-rastvaranje
Након што погледаш линк, прочиташ лекцију из свеске, прелисташ уџбеник, на коментару или вајбер групи постави питања, уколико постоје нејасноће.
У свесци за хемију одговори на питања:
- Одреди која је супстанца растварач у растворима који настају растварањем 20 гр кухињске соли у 100 гр воде?
- мешањем 200 гр воде и 100 гр алкохола?






Samanta uradila
ReplyDeleteUradio
ReplyDeleteDejana uradila
ReplyDeleteMilica uradila
ReplyDeleteGordana uradila
ReplyDeleteУрађен домаћи задатак евидентиран је за сваког ученика у електронски дневник! ко је оставио коментар добио је плус.Пратићу стање сваке недеље, на основу актвности бићете оцењени!
ReplyDeleteUradila
ReplyDeleteHelena
Uradila i pročitala
ReplyDeleteHelena Eres
Uradila i pročitala
ReplyDeleteMilica Branjesku
Uradio i procito S Stanojev
ReplyDeletePrepisala
ReplyDeleteHelena
Prepisala
ReplyDeleteMilica Branjesku
Prepiso
ReplyDeleteStrahinja Stanojev
Prepisala i uradila
ReplyDeleteHelena Ereš